無水酢酸の加水分解反応を調べた。 2実 験 21試 料 酢酸は市販特級品を精留したものを用いた。無水酢酸は市販特 級品を脱水剤にナトリウムを用い還流したのち,ナ トリウムと炭 酸ナトリウムを加えて減圧蒸留し,さ らにトリフェニノvアミンを分子式 (C6H5NH2)2・H2SO4 分子量 別名 硫酸アニリン CAS Number 国連番号 2811 外観 白色~ほとんど白色の結晶又は結晶性粉末 沸点 融点 法的規制 毒物及び劇物取締法 : 劇物 (法第2条別表第2)、包装等級Ⅲ 船舶安全法 : 毒物類、毒物 航空法 : 毒物類、毒物 · アニリンに無水酢酸を直接混ぜると急激に反応が起こり発熱するので,なんらかの対策が必 要となる。本実験では無水酢酸を氷酢酸で薄めて使う方法を採用している。アニリンは酸性条 件下で,アニリニウムイオンとなり水に溶けやすくなる(図2)。

122 80 5 P アミノアセトアニリド P Aminoacetanilide 015 019 詳細情報 試薬 富士フイルム和光純薬
アニリン 無水酢酸 反応名
アニリン 無水酢酸 反応名-アセトアニリドは、アニリンを無水酢酸と反応させてアセチル化して合成できる。アニリニウム塩や塩化アセチルを使っても良い。 性質 熱水に溶ける。545 ℃ まで加熱すると発火するが、通常の条件では安定。純粋な結晶は無色である。 用途林 純薬工業株式会社 無水酢酸 改訂日 sds コード a2 バージョン 061 3/8 化学名又は一般名 濃度又は濃度範囲 化学式 官報公示整理番号 cas rn 化審法番号 安衛法番号 無水酢酸 ≧930% c4h6o3 (2)690 既存化学物質 1047




昔のおくすり せきどめ Commew
· アセチル基は最も有名な官能基の一つです。 この記事ではアセチル基の構造、化学的性質や特徴などを紹介します。 アセチル基とは?高校化学でも登場!アセチル基の構造 アセチル基はCH3-COで表される官能基の一つです。略称は「これに濃塩酸を加えると,アニリンは塩酸塩となって水に溶けます。 C 6 H 5NH 2 +HCl→C 6 H 5NH 3 + Cl - これに無水酢酸を加え,さらに飽和酢酸ナトリウム水溶液を加えていくと,白濁します。これはアセトアニリドの沈殿です。アニリンに酢酸を加えただけでは アンモニウム塩ができるだけで、この塩から脱水する反応にエネルギーが必要、 且つ 活性化エネルギーも大きい。よって、長時間の高温が必要になる。 通常は無水酢酸を作用させる方法が簡便である。
日本大百科全書(ニッポニカ) アセトアニリドの用語解説 酢酸とアニリンのアミド。アセチルアニリン、nフェニルアセトアミドともいう。アニリンに無水酢酸あるいは塩化アセチルを反応させて得られる。無色の板状結晶。冷水に約05%、熱水には約5%溶ける。 · 化学 アニリンと無水酢酸を反応させアセトアニリドつくったのですが。この際アニリンと無水酢酸を入れるビーカーは乾燥しているものを使えと指示が出ました。何故乾燥していないといけないのですか? · 慶應義塾大学日吉キャンパスにおける文系学生を対象とした化学実験のテーマの1つに, アセトアニリドの合成に関する実験がある。無水酢酸と氷酢酸の混合液を用いてアニリンをアセチル化する反応である。しかし, 反応条件(加熱還流の強さや時間など)について不明確な点があった。そ
アニリンが無水酢酸と反応したときの変化を化学反応式で示すと, C 6 H 5 NH 2 +(CH 3 CO) 2 O→C 6 H 5 NHCOCH 3 +CH 3 COOH設 問 (Problem) エステル化については、様々な方法があります。 たとえは、今回の実験で行った無水酢酸とアルコールを用いる方法、またはカルボン酸の酸塩化物とアルコールとの反応、さらにカルボン酸とアルコールを酸触媒で縮合させる方法が · 無水酢酸を使ったエステル化 無水酢酸は最もよく使われる酸無水物です。ohやnh 2 などの保護に使われることが多いです。 アセチル基は塩基・ヒドリド還元には弱いですが、酸にはある程度耐えます。 反応は簡単で無水酢酸を溶媒とします。




マルフォイ Marufoi710 Twitter




この 1 の B なんですが この反応ってカップリングじゃないんですか Clear
311 物質名 和名:無水酢酸、酸化アセチル 英名: Acetic anhydride;Acetic oxide 312 物質登録番号 CAS : 1047 UN TDG :1715 EC (Index) : () 313 物性 分子式: C刊行物名 issn 巻号ページ アニリンの合成法,性質,酸化反応,ジアゾ化反応,続くジアゾカップリング反応の基礎について述べ の教科書で取り上げられる,空気中での酸化・黄変,さらし粉水溶液による赤紫色の発色,無水酢酸との反応によるアセトアニリド



127 09 3 酢酸ナトリウム Sodium Acetate 196 198 198 190 192 詳細情報 分析 常用試薬 ラボウェア 合成 材料 試薬 富士フイルム和光純薬




494 Cooch3 2 B Nhcoch3 C Ch3 See How To Solve It At Qanda
–43– 311 アセトアニリドの合成 100 mLのビーカーに無水酢酸ナトリウム約15 g1を入れ、水6 mLを加えて溶解する。別に、 50 mLのビーカーに水25 mLと濃塩酸(12 mol/L)10 mLを加えた溶液を作り、これにアニリンOh 無水酢酸 ococh3 cooh cooh サリチル酸 アセチルサリチル酸 nh2 無水酢酸 nhcoch3 アニリン アセトアニリド 分解 ・エステルの加水分解(エステル化の逆反応) 希酸 R-C-O-R'+ H2O R-C-OH + H-O-R' ‖ ‖ O OCAS RN®1047 化学物質名(和名)無水酢酸 化学物質名(英名)ACETICANHYDRIDE 分子式C4H6O3 示性式 (CH3CO)2O SMILESO=C (OC (=O)C)C RTECSAK




122 80 5 P アミノアセトアニリド P Aminoacetanilide 015 019 詳細情報 試薬 富士フイルム和光純薬



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校
特許(日特開昭,ほ か)によると,反応温度 170~180℃,反 応圧力25~50気 圧,触 媒としてRhCl3CH3I窒 素化合物Cr(CO)6を 用いた時,無水酢酸の選 択率は90%以 上になる。 2 性 質 無水酢酸はアセトン,ベ ンゼン,エ チルエーテル,酢無水酢酸 (ch 3 co) 2 o の代表的な求核的アシル置換反応を、次の図16 に示します。 図16 無水酢酸 (ch 3 co) 2 o の代表的な求核的アシル置換反応 無水酢酸 (ch 3 co) 2 o を加水分解すると、カルボン酸である酢酸 ch 3 cooh に戻ります。アセトアニリドは、無水酢酸とアニリンとの間の反応によって製造することができる。しかし、製造時にはアニリンは有毒であり、皮膚を通して吸収される可能性があるため、反応はヒュームフードの下で行われるべきです。 c 6 h 5 nh 2 (ch 3 co) 2 o→c 6 h 5 nhcoch 3 ch 3 cooh




1994 号 ロイコトリエン生合成を阻害するインドール誘導体 Astamuse




Woa1 n フェニルマレイミド化合物およびそれを使用して得られる共重合体組成物 Google Patents
酢酸、ナフタリン、カンファ、グリセリン、テレビン油、アルコール類、一般還元性 物質 無水ふっ化水素酸 アンモニア (含水、あるいは無水) 硝酸 (濃) 酢酸、アニリン、クロム酸、シアン酸、硫化水素、引火性液体、引火性ガス 硫酸アニリンの測定方法 ・固相抽出-ガスクロマトグラフ質量分析法 1 試薬 ・標準物質:アニリン標準品(試薬特級) ・サロゲート内標準物質:アニリン2,3,4,5,6d5(996 atom % D) ・シリンジスパイク内標準物質:ナフタレンd8 標準品(98%)(注1)(1) 無水酢酸製造工場で、無水酢酸とジケテンc 4 h 4 o 2 、触媒naohの反応により、デヒドロ酢酸を製造するテスト中に異常反応により急激な昇圧、昇温を生じ回収かんが爆発した。 (2) 塩化メチレンと過酸化水素の溶液に無水酢酸を加えてかく拌中に爆発した。
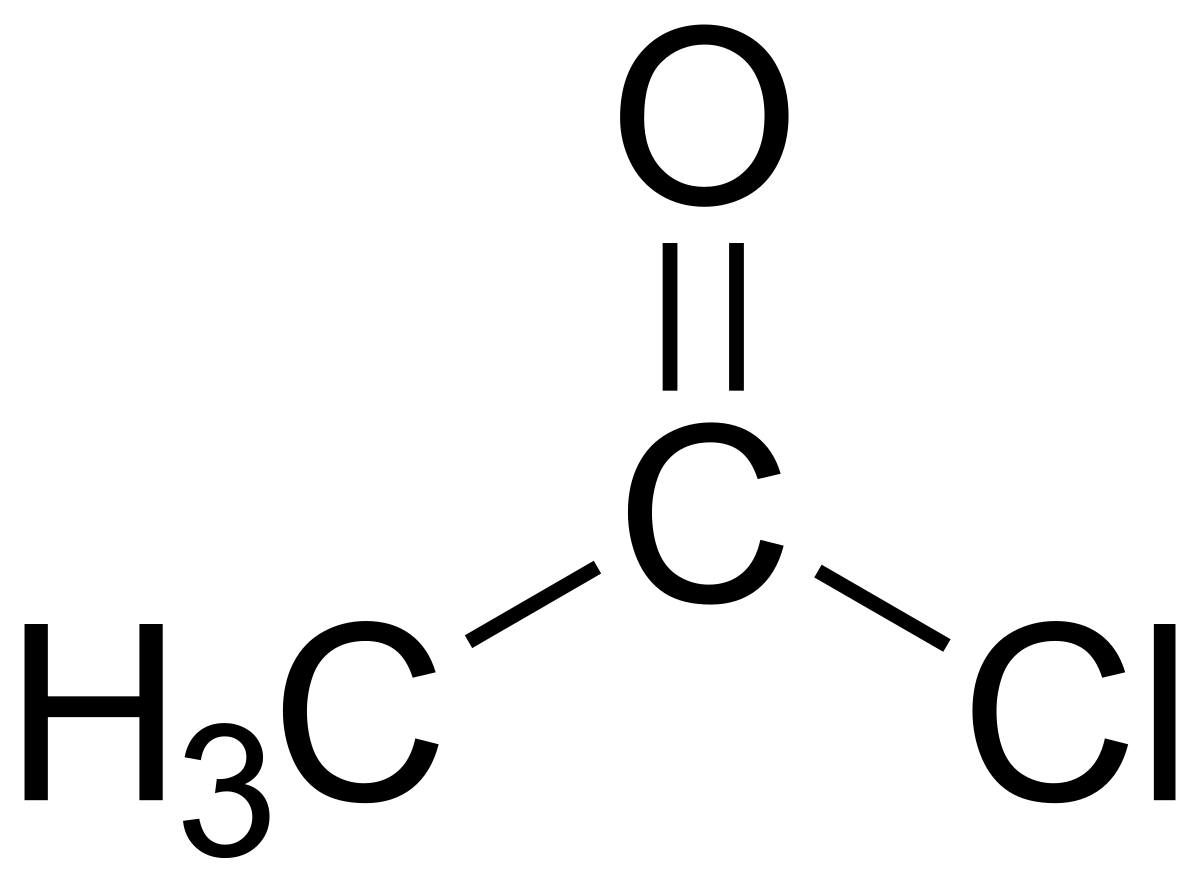



塩化アセチル Wikipedia




2 ニトロアニリン Wikipedia
化学名 経口LD50皮吸入 LC50 無水酢酸630 mg/kg ( Rat ) 4,000 mg/kg ( Rabbit )1,000 ppm ( Rat ) 4 h 化学名 急性毒(経口)分類根拠皮吸入ガス 無水酢酸NITEのGHS分類に基づく。NITEのGHS分類に基づく。NITEのGHS分類に基づく。 化学名 急性毒(吸入蒸気)分類根拠粉塵ミスト 根拠無水酢酸 c 4h 6o 3 = 1021、刺激臭を有する無色の液体。沸点140 oc、密度 108、水に難溶。 水と徐々に反応して酢酸になる。 酢酸ナトリウム c 2h 3o 2na = 981、無色の結晶。吸湿性で水に可溶。 アセトアニリド oc 8h 9no = 135:無色板状晶(水から再結晶)、融点113慶應義塾大学日吉キャンパスにおける文系学生を対象とした化学実験のテーマの1つに, アセトアニリドの合成に関する実験がある。無水酢酸と氷酢酸の混合液を用いてアニリンをアセチル化する反応である。しかし, 反応条件(加熱還流の強さや時間など)について不明確な点があった。そこで実験条件を変えて合成を行ってみた。その結果, 収量は加熱の強さや加熱




アミド Wikipedia



Topics
· 2,6ジメチルアニリンと酢酸の反応 0000 大学の合成実験で、2,6ジメチルアニリンに酢酸を加えたら、溶液の色が速やかに黄色から紫色に変わりました。 これはアミノ基が酢酸によってアミドになったためでよいのでしょうか? tirol19 お礼率80% (8カップリング反応を使って合成できる色の構 造を探る。 2.仮説 カップリング反応で生成できる色は暖色が多 いといわれているが、アゾ基以外の要因によっ て暖色以外の色素も生成できる。 3.実験・結果・考察 実験1αナフトールとアニリンの反応10.安定性及び反応性 反応性 通常の取扱い条件下では安定である。 化学的安定性 通常の取扱い条件下では安定である。 危険有害反応可能性 加熱、または酸と接触すると分解し、アニリン、窒素酸化物、塩化水素などの有毒で腐食性のヒュームを生じる。




21 号 マレイミド化合物及びその製造方法 アミド酸化合物及びその製造方法 樹脂組成物 硬化物 樹脂シート プリプレグ 金属箔張積層板 プリント配線板 封止用材料 繊維強化複合材料 接着剤 並びに半導体装置 Astamuse




108 24 7 無水酢酸 Acetic Anhydride 019 詳細情報 医薬品 製造 品質管理 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




高校化学 アニリンと無水酢酸の反応 映像授業のtry It トライイット




H10 C12 N14 O16 Lihat Cara Penyelesaian Di Qanda




アセトアニリドの合成 アセトアニリド 再結晶 Tlc 薄層クロマトグラフィー 融点測定 Transblog




103 84 4 アセトアニリド Acetanilide 017 011 詳細情報 ライフサイエンス 試薬 富士フイルム和光純薬
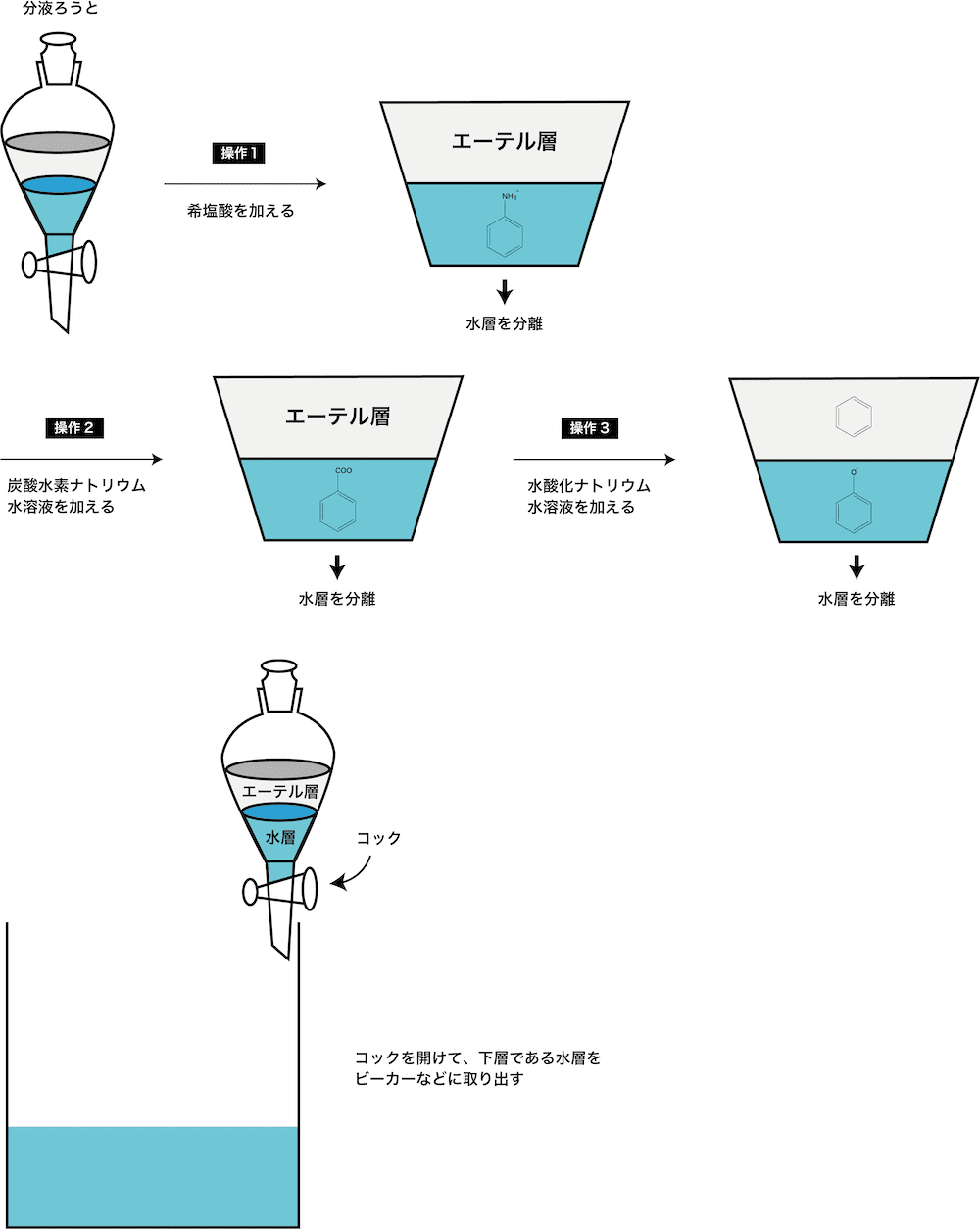



有機化合物 芳香族 の分離法 仕組みや実験手順などを解説 化学のグルメ




アニリン塩酸塩 Wikipedia




高校化学 アニリンと無水酢酸の反応 映像授業のtry It トライイット



ニトロ化反応の条件とやり方 ネットdeカガク




無水酢酸 Acetic Anhydride Japaneseclass Jp




アセトアニリドの合成 アセトアニリド 再結晶 Tlc 薄層クロマトグラフィー 融点測定 Transblog




メルカリ 化学重要問題集 16 参考書 333 中古や未使用のフリマ




H10 C12 N14 O16 Lihat Cara Penyelesaian Di Qanda




有機化合物です 急ぎです お願いします Clear




アニリン Wikipedia




芳香族アミン 高校化学 化学基礎一問一答 化学のグルメ




Wo14 号 フルオレン系化合物 該フルオレン系化合物を含む光重合開始剤 および 該光重合開始剤を含む感光性組成物 Astamuse




高校化学 アニリンの製法 映像授業のtry It トライイット




Descubre Como Resolverlo En Qanda




高3 化学5 アミン 高校生 化学のノート Clear




21 0243号 B ケトスルフィド化合物 光硬化剤及びそれらを含む感光性樹脂組成物 Astamuse




アニリンのジアゾ化やカップリングなどの語呂合わせ 18東工大 第12問よりその1 入試化学を語呂合わせで解く大学入試ゴロ化学



質問ですアセトアニリドの合成において 純水にアニリン 濃塩酸 無水酢酸ナトリ Yahoo 知恵袋




3 Lihat Cara Penyelesaian Di Qanda



cssh体験型実習講座in山大 有機合成化学 が行われました 山形県立 東桜学館 中学校 高等学校




127 09 3 酢酸ナトリウム Sodium Acetate 198 詳細情報 医薬品 製造 品質管理 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




3 Lihat Cara Penyelesaian Di Qanda




この 1 の B なんですが この反応ってカップリングじゃないんですか Clear




Nbsでのブロモ化に 酢酸アンモニウムをひとつまみ Chem Station ケムステ




芳香族アミン 高校化学 化学基礎一問一答 化学のグルメ



H10 C12 N14 O16 Lihat Cara Penyelesaian Di Qanda




昔のおくすり せきどめ Commew




Lihat Cara Penyelesaian Di Qanda




2 の解き方を教えてください Clear



3 Lihat Cara Penyelesaian Di Qanda




高校化学 アニリンと無水酢酸の反応 練習編 映像授業のtry It トライイット




108 24 7 無水酢酸 Acetic Anhydride 011 017 011 詳細情報 合成 材料 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




アセトアニリド Wikipedia




Nbsでのブロモ化に 酢酸アンモニウムをひとつまみ Chem Station ケムステ




アセトアニリドの合成 アセトアニリド 再結晶 Tlc 薄層クロマトグラフィー 融点測定 Transblog



122 80 5 P アミノアセトアニリド P Aminoacetanilide 015 019 詳細情報 試薬 富士フイルム和光純薬




有機化合物の分離 アニリン 安息香酸 ナフタレン フェノールを 有機層 Okwave




62 53 3 アニリン Aniline 019 019 詳細情報 分析 常用試薬 ラボウェア 試薬 富士フイルム和光純薬




反応機構がわからなくて困ってます 画像の反応機構を教えてください 図で Okwave
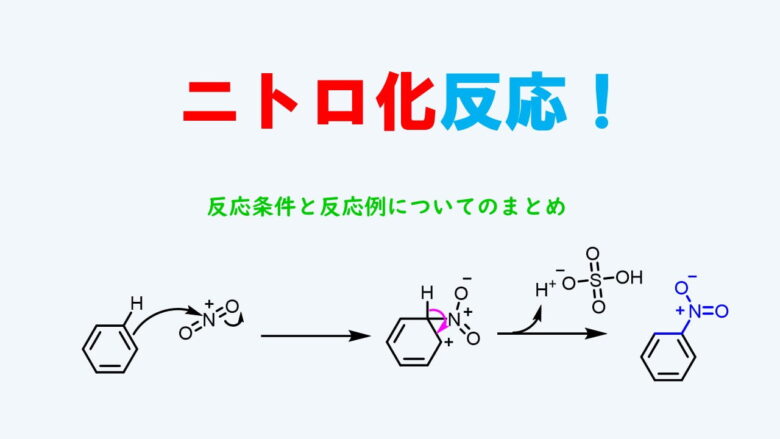



ニトロ化反応の条件とやり方 ネットdeカガク




Nbsでのブロモ化に 酢酸アンモニウムをひとつまみ Chem Station ケムステ




アセトアニリド 合成 アセトアニリドの合成実験
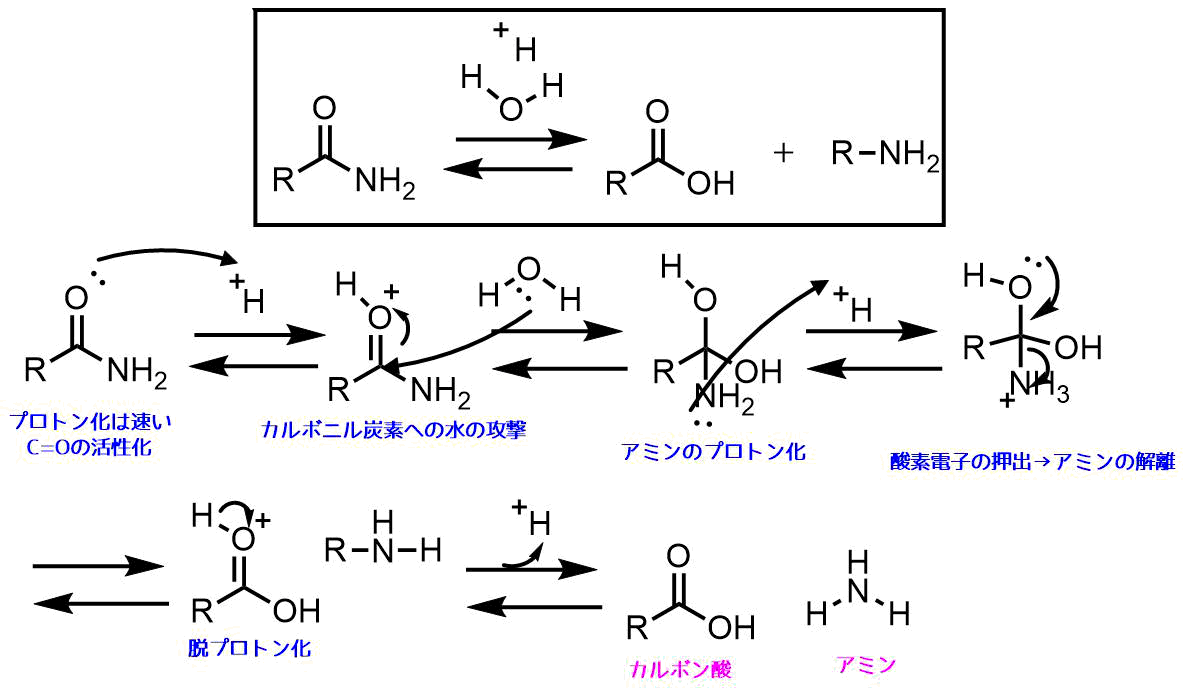



ニトロ化反応の条件とやり方 ネットdeカガク
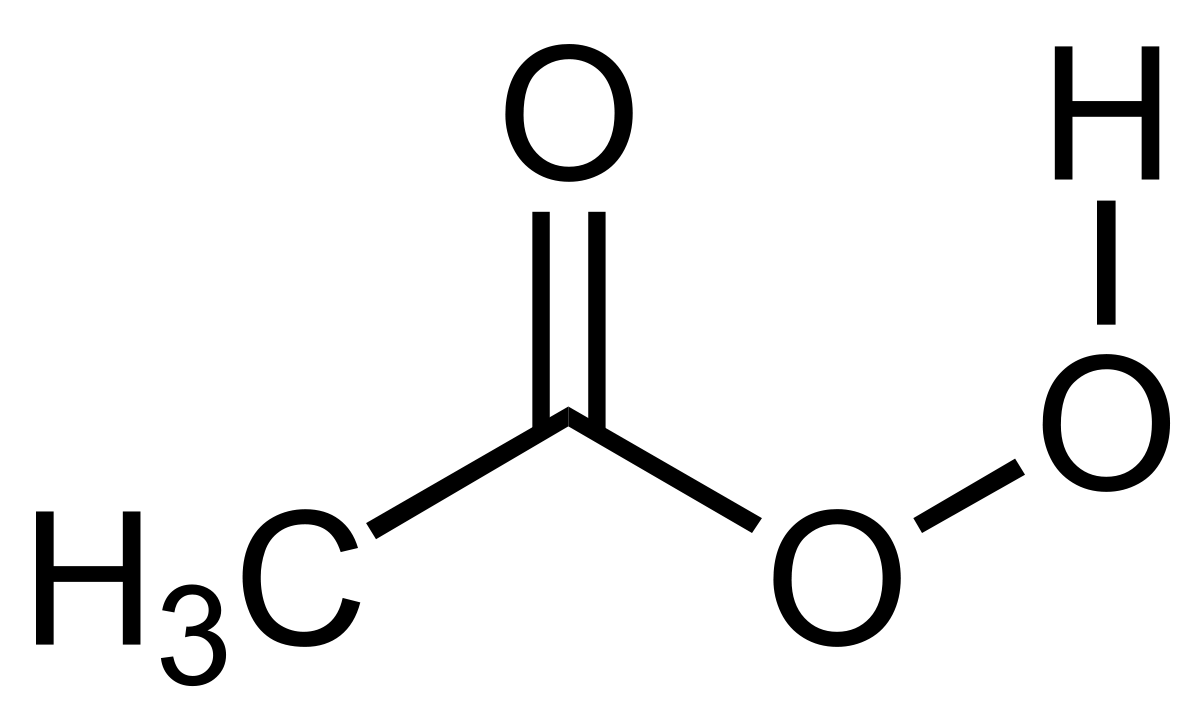



過酢酸 Wikipedia
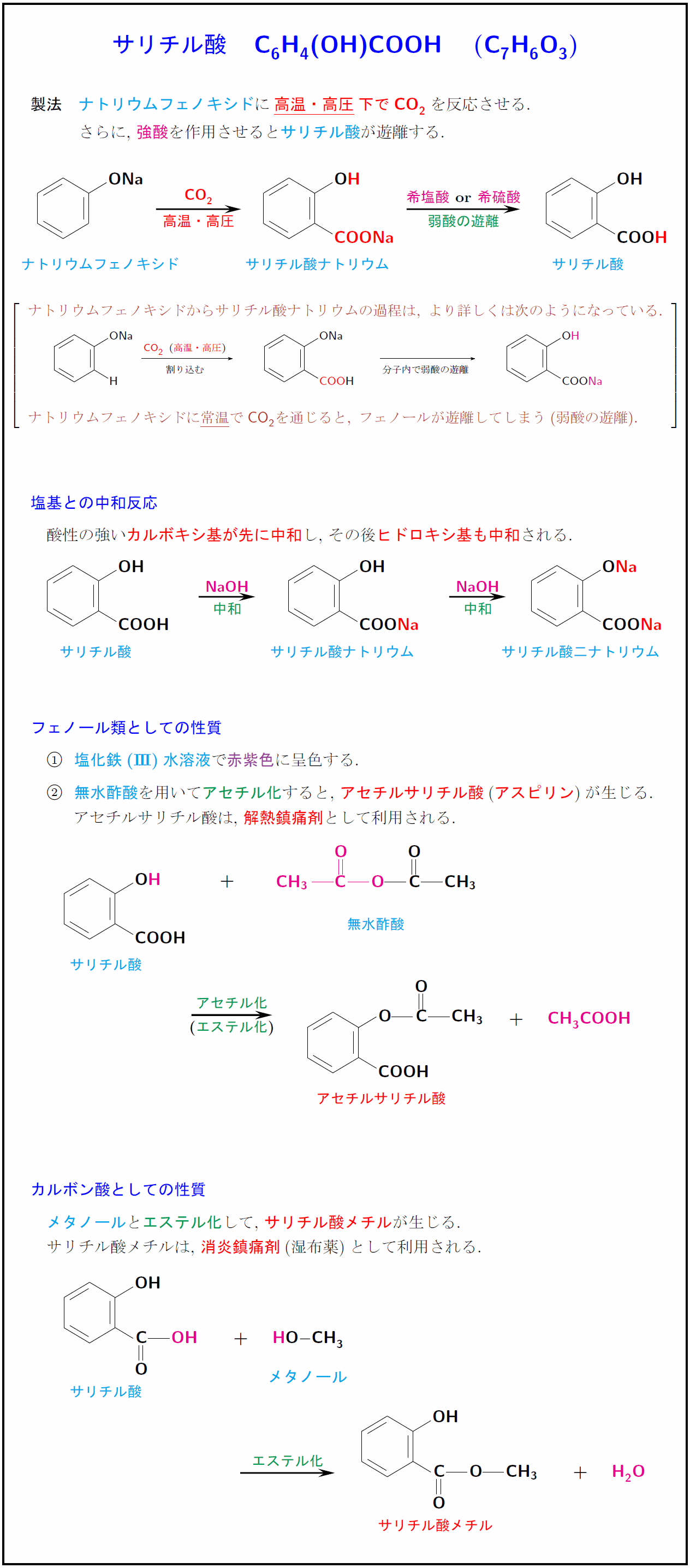



高校有機化学 サリチル酸の製法と性質まとめ 受験の月




Bzelptlupjxxfm




1 Lihat Cara Penyelesaian Di Qanda




P電子自由自在 C C ポリジアセチレン ナノワイヤー Fet素子 結晶工学 ナノ複合体 結晶内反応 イナミン化合物 環状化合物 Ppt Download




3 Lihat Cara Penyelesaian Di Qanda




芳香族アミン アニリン の構造 製法 性質 反応 化学のグルメ



ニトロ化反応の条件とやり方 ネットdeカガク
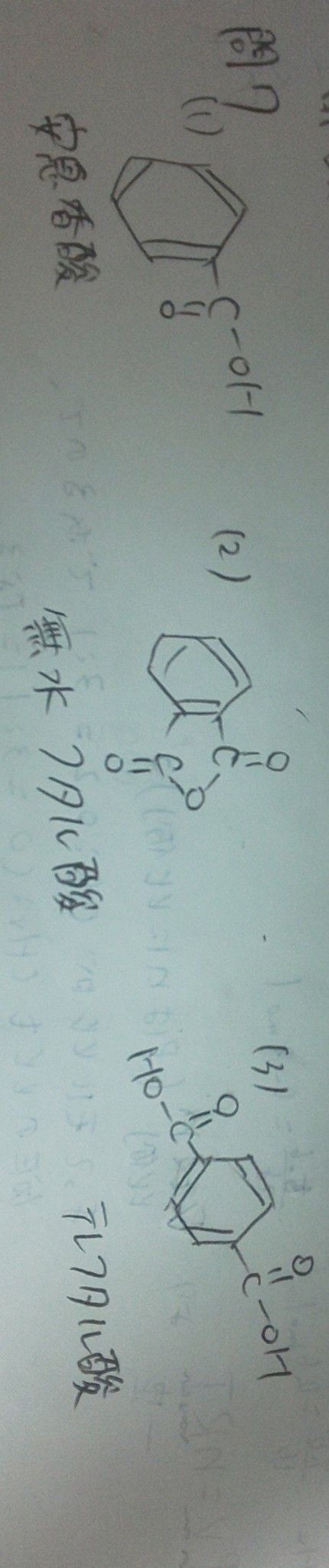



Lihat Cara Penyelesaian Di Qanda



0 件のコメント:
コメントを投稿